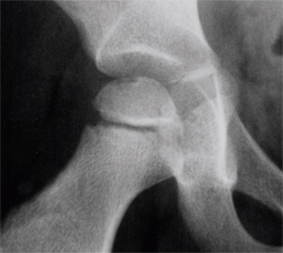
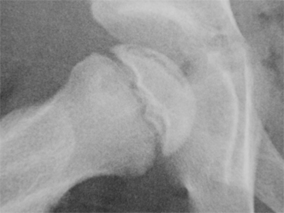
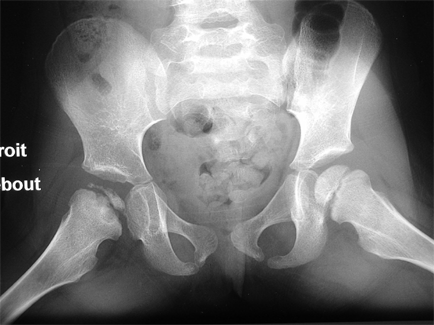
OSTEOCHONDRITE PRIMITIVE DE HANCHE ou MALADIE DE LEGG-PERTHES-CALVE
Points essentiels
L’ostéochondrite primitive de hanche (OPH), ou maladie de Legg-Calvé-Perthes est une destruction partielle ou totale de la tête du fémur par diminution d'apport sanguin, qui atteint surtout le garçon entre 3 et 12 ans.
Plusieurs facteurs ont été incriminés dans son origine, sans pouvoir être démontrés avec certitude.
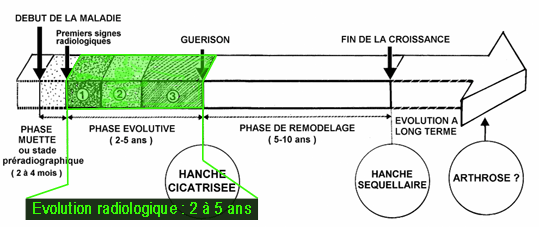
Son évolution est marquée par trois phases :
![]() la phase évolutive proprement dite, qui dure 2 à 5 ans,
la phase évolutive proprement dite, qui dure 2 à 5 ans,
![]() la phase de remodelage (cicatrisation naturelle) qui s’étend
entre la fin de la maladie et la fin de la croissance,
la phase de remodelage (cicatrisation naturelle) qui s’étend
entre la fin de la maladie et la fin de la croissance,
![]() la phase séquellaire, qui se prolonge dans la vie adulte, pouvant
aboutir à l’arthrose (usure prématurée de
l'articulation).
la phase séquellaire, qui se prolonge dans la vie adulte, pouvant
aboutir à l’arthrose (usure prématurée de
l'articulation).
 |
|
|
L’évaluation de l'ostéochondrite (sa sévérité, son évolution, et les déformations résiduelles) se fait surtout grâce à la radiographie standard et l’imagerie par résonance magnétique (I.R.M.).
Les principaux facteurs de mauvais pronostic à long terme sont:
![]() la survenue de la maladie après l'âge de 10 ans,
la survenue de la maladie après l'âge de 10 ans,
![]() l’étendue de la nécrose (le pourcentage de la tête
du fémur atteint),
l’étendue de la nécrose (le pourcentage de la tête
du fémur atteint),
![]() l’incongruence entre la tête fémorale et le cotyle,
et l’excentration (tendance à la luxation de la tête
fémorale en dehors du cotyle).
l’incongruence entre la tête fémorale et le cotyle,
et l’excentration (tendance à la luxation de la tête
fémorale en dehors du cotyle).
Le traitement de l'ostéochondrite de hanche a évolué et cherche à rétablir une hanche concentrique, congruente, et mobile.
Il varie de la simple surveillance dans les formes mineures chez un jeune enfant, au traitement chirurgical par ostéotomies du fémur et/ou du bassin dans les formes sévères avec excentration, chez un enfant plus âgé, en passant par le traitement orthopédique par plâtre ou appareillage, dans les formes intermédiaires.
Il faut signaler que ce traitement varie d'une culture médicale à l'autre, d'un pays ou d'un région à l'autre, ce qui explique la perplexité des familles à la recherche de renseignements médicaux.
Pour mieux comprendre
 |
|
|
Introduction
L’ostéochondrite primitive de la hanche (OPH), également connue sous le nom de maladie de Legg-Calvé-Perthes (LCP), fut décrite d’une façon indépendante en 1909 par Legg aux Etats Unis, Perthes en Allemagne, et Calvé en France.
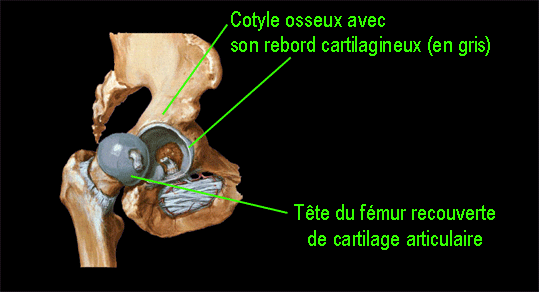
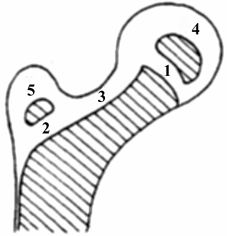
Décrite initialement comme une infection pseudo-tuberculeuse de la hanche, cette affection est actuellement reconnue comme étant en rapport non pas avec une infection, mais plutôt avec une nécrose avasculaire du noyau d’ossification de l’épiphyse fémorale (voir le schéma ci-dessous).
 |
|
1°/ Zone de croissance sous-capitale |
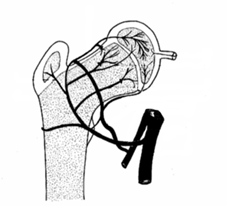 |
Ce réseau sanguin se modifie en cours de croissance, expliquant probablement une période de "fragilité vasculaire" provisoire de la hanche de l'enfant. |
Epidémiologie
[6,12,22,24,28,33,38,41]
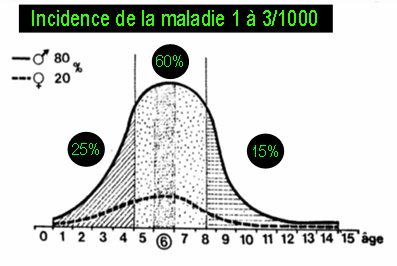
Cette maladie atteint 1 enfant sur 2000 en moyenne, ne touche souvent qu'un seul côté, et survient essentiellement chez le garçon entre 4 et 10 ans.
 |
|
|
Elle est plus fréquente dans certaines races (ex : japonais), et beaucoup plus rare chez les noirs ; sa découverte chez un enfant de race noire doit faire rechercher une hémoglobinopathie (maladie du sang).
Malgré l’absence de certitude concernant la présence d’un facteur génétique, il existerait un terrain familial prédisposant, témoignant d’une hérédité multifactorielle [29] .
Les enfants atteints ont en général une taille plus petite que la moyenne pour l’âge, avec un retard d’âge osseux de 1 ou 2 ans [25].
L’association à d’autres ostéochondrites ou malformations congénitales serait plus fréquente.
Quelle est l'origine de la maladie (étiologie) ?
L’étude microscopique des tissus malades (histopathologique) prélevés chez des enfants atteints révèle la présence de plages de nécrose osseuse avasculaire entremêlées de zones de reconstruction.
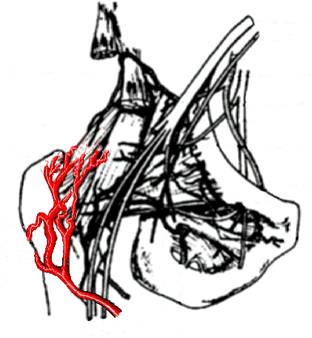 |
|
Entre l'âge de 4 ans et de 7
ans, le réseau circonflexe antérieure n’a
presque aucun rôle dans la vascularisation de la tête
du fémur. |
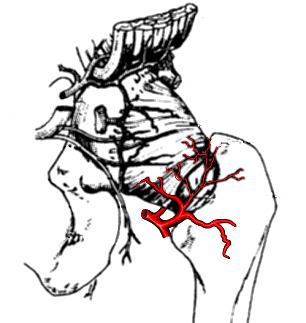 |
L’origine exacte de ce trouble vasculaire reste inconnue ; une occlusion artérielle ainsi qu’une perturbation du drainage veineux ont été évoqués.
Les travaux les plus récents s’orientent vers la possibilité de troubles de la coagulation [1,2,9,11,17].
Cependant, la prédominance masculine, la turbulence des enfants présentant une OPH, et les antécédents d’activité excessive avant le début de la maladie, peuvent faire évoquer le rôle des microtraumatismes, qui produiraient en quelque sorte, une ischémie épiphysaire fémorale partielle.
Les travaux expérimentaux sur l’animal ont montré qu’une lésion répétée de l’artère fémorale circonflexe postérieure est nécessaire pour produire des anomalies histologiques et radiographiques, similaires à celles retrouvées chez l’enfant, anomalies qu’un épisode isolé d’ischémie n’a pas réussi à produire chez le chien [37].
Histoire naturelle de l'ostéochondrite primitive de hanche
[3,4,22,29,32,43 ]
C'est l'évolution spontanée, sans aucun traitement, de
la maladie.
Elle reste difficile à tracer avec certitude
pour deux raisons principales :
![]() plusieurs
publications montrent que l’évolution de cette maladie
est extrêmement variable d’un patient à l’autre.
plusieurs
publications montrent que l’évolution de cette maladie
est extrêmement variable d’un patient à l’autre.
![]() dans la littérature,
aucun travail ne rapporte une série de patients porteurs d’une
OPH et jamais traités, ne serait ce que par des moyens simples
(plâtre, traction, …).
dans la littérature,
aucun travail ne rapporte une série de patients porteurs d’une
OPH et jamais traités, ne serait ce que par des moyens simples
(plâtre, traction, …).
Cependant, il est possible de diviser l’évolution de l’OPH
en trois grandes parties : la phase évolutive,
la phase de remodelage,
et la phase séquellaire.
Les deux premières restent limitées à la période de croissance de l’enfant, alors que la dernière commence dès la fin de la croissance et se prolonge dans la vie adulte.
La phase évolutive dure 2 à
5 ans, et comporte quatre stades :
![]() le stade
dit pré-radiographique, d’une durée variable de
2 à 4 mois, correspond à l’agression vasculaire
initiale. Il s’agit de la vraie nécrose osseuse, au stade
où elle n’est pas encore visible radiologiquement.
le stade
dit pré-radiographique, d’une durée variable de
2 à 4 mois, correspond à l’agression vasculaire
initiale. Il s’agit de la vraie nécrose osseuse, au stade
où elle n’est pas encore visible radiologiquement.
![]() le stade
de condensation, reconnu à tort comme le stade de nécrose.
le stade
de condensation, reconnu à tort comme le stade de nécrose.
![]() le stade
de fragmentation
le stade
de fragmentation
![]() le stade
de reconstruction
le stade
de reconstruction
Il n’existe pas de zone de transition nette entre les trois derniers
stades.
En effet, l’évolution de la maladie est marquée pendant cette période, par des nécroses à répétition, des efforts de réparation avec résorption des zones nécrosées, et enfin la réapparition d’un tissu osseux spongieux normal.
La phase de remodelage fait suite à
la phase de reconstruction, et se caractérise par l’adaptation
entre la tête fémorale et l’acétabulum, sous
l’effet de la croissance.
Elle se fait le plus souvent dans le sens de l’amélioration de la morphologie et de la fonction de la hanche. Bien qu’elle ne corresponde pas à une évolution de la maladie, elle représente une partie importante de son histoire naturelle, étant donné que la morphologie définitive de la tête fémorale n’est acquise qu’en fin de croissance.
La phase séquellaire débute
dès la fin de la croissance, et se prolonge dans la vie adulte.
La forme de la tête fémorale ne se modifie plus. La tolérance clinique est souvent très bonne à court terme, quel que soit l’aspect radiographique.
Les auteurs ayant évalué à long terme le devenir des hanches atteintes d’OPH, rapportent des taux variables de coxarthrose.
A moyen terme, le risque d’arthrose reste modéré, et il n’existe pas de parallélisme entre les signes radiographiques d’arthrose et les signes cliniques.
Le pronostic à long terme semble directement lié à la morphologie de la hanche à la fin de la phase de remodelage, et surtout à la congruence entre la tête fémorale et l’acétabulum. Ainsi, s’il existe une complémentarité de forme entre ces deux composants anatomiques de la hanche, l’arthrose n’apparaît que tardivement et reste longtemps tolérée, même si la tête fémorale est irrégulière.
Tableau clinique : comment se manifeste l'ostéochondrite de hanche ?
Les premiers signes d'ostéochondrite de hanche
Les parents sont les premiers à remarquer la boiterie qui constitue le motif de consultation le plus fréquent.
La douleur, est par ordre de fréquence, le deuxième motif de consultation.
Elle siège souvent autour de la hanche (fesse, région du grand trochanter, ou pli de l’aine), mais il n’est pas rare que l’enfant se plaigne d’une douleur exclusive au genou, pouvant tromper un examinateur peu averti.
Ces deux symptômes, boiterie et douleur, s’aggravent en fin de journée, après une période d’activité physique entretenue, et diminuent avec le repos.
On retrouve souvent dans l’histoire la notion d’un incident traumatique (chute, accident de sport) ayant déclenché la douleur, quelques mois auparavant.
Les parents se plaignent souvent d’avoir un enfant hyperactif et turbulent, et le trouvent de petite taille par rapport à son âge.
L'examen clinique
La simple observation de l’enfant dans la salle d’examen sans qu’il ne s’en rende compte est essentielle.
L’analyse du type de boiterie montre qu’il s’agit le plus souvent de l’association d’une boiterie antalgique (appuis brefs sur le membre atteint) et d’un Trendelenbourg (bascule du bassin du côté opposé en appui sur une jambe sur le membre atteint).
Un certain degré d’amyotrophie de la fesse et de la cuisse du côté douloureux est présent dans les formes découvertes tardivement.
Dans la plupart des cas, il existe une légère limitation de la mobilité de la hanche en abduction et rotation interne, plus importante dans les formes sévères et tardives. Cette limitation de la mobilité évolue dans la journée parallèlement à la boiterie, est plus nette en fin de journée, et discrète le matin ou après une longue période de repos.
Au début de la maladie, elle est due à un spasme musculaire, essentiellement adducteur, et un examen lent et doux permet de s’en rendre compte. Au fur et à mesure de l’évolution, surtout dans les atteintes sévères, la raideur de la hanche en abduction et rotation interne s’aggrave, de même que la boiterie, en rapport avec le spasme et la rétraction musculaires d’une part, et la déformation de la hanche d’autre part.
L'imagerie dans l'ostéochondrite de hanche
La radiographie standard : les signes de la maladie
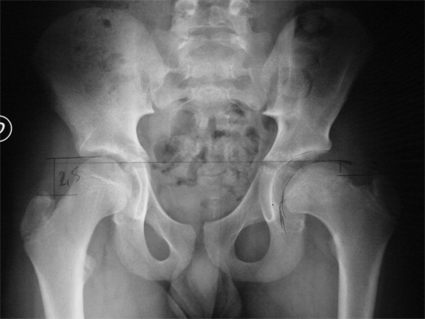
Une radiographie du bassin de face en rotation neutre des hanches, et une radiographie du bassin de face, incidence « grenouille » (montrant les têtes fémorales de profil), représentent le bilan radiographique initial d’une OPH.
Aux premiers stades de la maladie, la radiographie est normale.
Qu'est-ce qu'une radiographie normale de hanche : les repères essentiels sont les suivants :
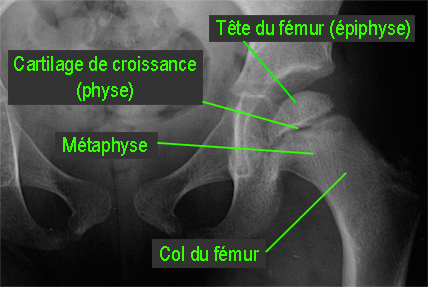 |
|
|
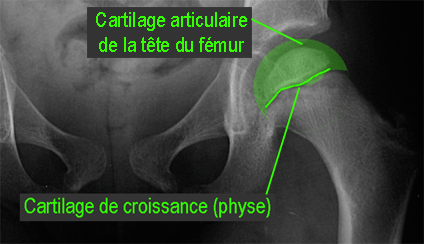 |
Les premiers signes radiographiques apparaissent deux à quatre
mois après le début, et se caractérisent par une
tête du fémur de petite taille.
Une fracture sous chondrale de l’épiphyse peut survenir, et apparaît radiologiquement comme une ligne claire sous corticale, surtout visible sur l’incidence « grenouille ». Cet aspect est connu sous le terme image en « coup d’ongle ».
L’interligne articulaire s’élargit en rapport avec l’épaississement du cartilage articulaire.
|
|
|
|
Le stade de condensation comme son nom
l’indique, est caractérisé par une densification
du noyau de la tête fémorale. Elle s’associe souvent
à un aplatissement épiphysaire, et parfois à une
image en « coup d’ongle ».
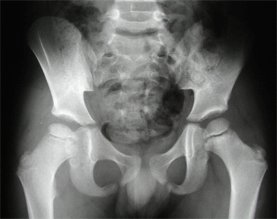 |
| |
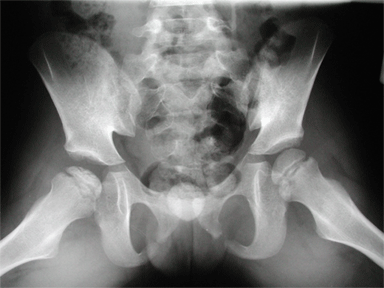 |
|
|
Le stade de fragmentation est caractérisé
par des images associant os dense, os normal, et image claire.
Cette fragmentation peut être totale, intéressant toute la tête du fémur, ou uniquement une partie. Des remaniements de la partie haute du col du fémur et de la zone de croissance peuvent être associées (élargissement, géodes osseuses, …).
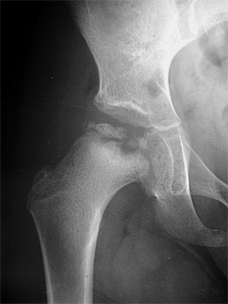 |
Le stade de reconstruction commence avec
les premiers signes de réossification, et s’étend
jusqu’à la reconstitution d’un tissu osseux normal
de toute l’épiphyse, quelle que soit sa morphologie définitive.
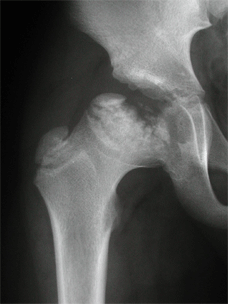 |
Pendant la phase de remodelage, il ne se
produit plus de modification de la texture radiologique de l’os,
mais plutôt une modification de forme de la tête fémorale
et de l’acétabulum avec la croissance, en rapport avec
une adaptation de ces deux éléments entre eux.
Ce remodelage est d’autant plus important que l’atteinte est survenue à un âge jeune. A l’issue de cette phase, la tête fémorale est soit normale, soit aplatie (coxa plana), et soit augmentée de volume (coxa magna).
 |
Le caractère sphérique de la tête fémorale , ainsi que la congruence entre tête du fémur et cotylee, sont évalués à partir de ce stade (début de l’âge adulte), à l’aide de la méthode spécifiques de mesure (méthode de Mose [26], et de la classification de Stulberg [27,36] respectivement).
Après la fin de croissance, les images radiologiques restent
stationnaires pendant plusieurs années, avant qu’apparaissent
les premiers signes d’arthrose, avec un délai variable
en fonction de la sévérité de l’agression
épiphysaire, et de l’incongruence séquellaire entre
la tête du fémur et le cotyle.
La radiographie standard : l'étendue de la maladie
L’étendue de l'ostéochondrite est évaluée à l’aide de classifications radiographiques :
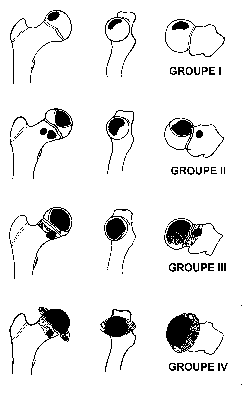
La classification de Catterall :
La classification de Catterall [4,5] est utilisée au stade de fragmentation, et apprécie l’étendue de la nécrose sur la radiographie du bassin en incidence « grenouille » (profil de tête fémorale).
Catterall subdivise la tête fémorale de profil en quatre quarts, et distingue quatre groupes de sévérité en allant d’avant en arrière, le groupe IV étant celui qui correspond à l’atteinte des quatre quarts, c’est-à-dire, de la totalité de l’épiphyse fémorale.
Catterall a également identifié cinq signes radiologiques de mauvais pronostic qui complètent sa classification (signes de tête à risque).
Malgré ses insuffisances, cette classification reste très utilisée.
 |
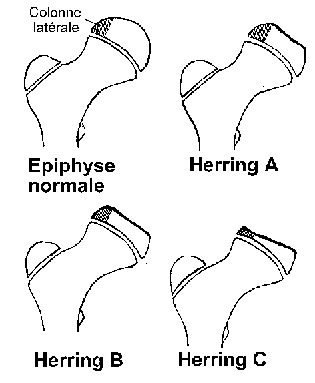
La classification de Herring
La classification de Herring [14] est la plus récente, et tient compte de la hauteur du pilier latéral de la tête fémorale sur une radiographie de face en rotation neutre.
La conservation d’une bonne hauteur du pilier latéral est un facteur de bon pronostic. Cette classification présente l’avantage d’être simple, d’avoir une meilleure correspondance interobservateur, et de ne nécessiter qu’une seule radiographie du bassin.
Elle est de plus en plus utilisée pour guider les indications thérapeutiques.
 |
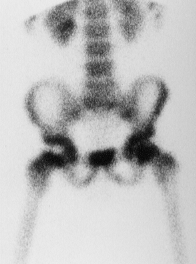
La scintigraphie osseuse au Technetium 99m
Elle trouve surtout sa place au premier stade de la maladie, dit pré-radiographique [21].
La présence d’une normofixation ou d’une hyperfixation permet d’éliminer le diagnostic d’OPH débutante.
Un trou de fixation n’a qu’une valeur de présomption (50% de faux positifs) et doit être confirmé par l’évolution radiographique.
 |
|
il s'agit d'une zone que le marqueur radio-actif ne peut imprégner car il n'y a plus de vascularisation sanguine à ce niveau, ce qui signe une ostéochondrite. |
L'imagerie par résonance magnétique (I.R.M.)
[7,15,16,18,23,30,34,35]
Elle présente un intérêt à la fois diagnostique
et pronostique.
En effet, elle permet de montrer des modifications de signal de la tête du fémur, bien avant l’apparition de signes radiographiques.
Elle permet en outre d’avoir une appréciation de l’étendue de la nécrose épiphysaire, et du degré d’excentration réelle de la tête fémorale, grâce à la visualisation du cartilage articulaire épaissi.
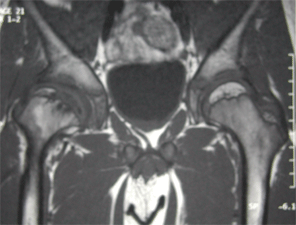 |
|
|
Les bilans biologiques
La numération formule sanguine, la vitesse de sédimentation, ainsi que les tests sériques de routine sont normaux.
Les tests de fonction thyroïdienne sont demandés dans les formes bilatérales, afin d’éliminer une éventuelle hypothyroïdie, dont les images radiologiques se rapprochent de celles d’une OPH.
Les présentations particulières de la maladie (formes cliniques)
Selon l’âge
La croissance résiduelle est un facteur pronostic déterminant.
En effet, et bien qu’il ne s’agisse pas d’une règle absolue, l’atteinte à un âge jeune (inférieur à 4 ans) offre à la hanche la possibilité d’un remodelage de plus longue durée, et partant une meilleure adaptation entre la tête fémorale et l’acétabulum.
D’autre part, l’atteinte après l’âge de 10 ans, constitue en soi un facteur de mauvais pronostic.
Selon le sexe
L’atteinte chez la fille survient en général un peu plus tôt, et a la réputation d’être à elle seule un facteur de mauvais pronostic [10].
Selon le côté
L’atteinte bilatérale survient dans 10 à 15 % des cas.
Les deux hanches évoluent en général à des stades différents [39].
Ostéochondrite disséquante
Un fragment nécrosé se détache du reste de l’épiphyse soit partiellement, soit en totalité.
Dans le second cas, il se comporte comme un corps étranger intra-articulaire, et doit être enlevé chirurgicalement.
Quelles sont les maladies qui ressemblent à l'ostéochondrite (diagnostic différentiel) ?
La liste des diagnostics différentiels devant un enfant présentant les images radiologiques sus-décrites, reste limitée.
Au stade préradiographique
L’OPH peut se confondre dans sa présentation avec la synovite aiguë transitoire (rhume de hanche).
En effet, une radiographie du bassin de face et en incidence grenouille, est en général prescrite deux à trois mois après un épisode de synovite aiguë transitoire, afin de détecter une OPH débutante.
Voir dans ce site le chapitre des Boiteries
Dans les formes bilatérales
Les principaux diagnostics différentiels à évoquer sont :
![]() une dysplasie de Meyer,
une dysplasie de Meyer,
![]() une hypothyroïdie,
une hypothyroïdie,
![]() une ostéonécrose secondaire,
une ostéonécrose secondaire,
![]() une dysplasie polyépiphysaire
une dysplasie polyépiphysaire
La dysplasie de Meyer serait une forme partielle de la dysplasie polyépiphysaire,
bénigne, et autolimitée, à évolution souvent
favorable. Elle n’a habituellement aucune traduction clinique,
est découverte fortuitement vers la seconde et la troisième
année de la vie, et guérit souvent sans aucun traitement
en deux ou trois ans.
Une hypothyroïdie doit être recherchée
systématiquement devant toute atteinte bilatérale, quel
que soit le tableau clinique.
En dehors de tout contexte traumatique ou de luxation
congénitale de la hanche traitée, une maladie du sang
(hémophilie, drépanocytose, maladie de surcharge, …)
doit être toujours recherchée devant une atteinte bilatérale.
L’évolution de l’atteinte épiphysaire dans
ce cas est en général plus rapide, sans passage par une
forme prolongée de fragmentation et de reconstruction.
Le diagnostic de dysplasie polyépiphysaire est facile à établir, grâce à la présence d’une atteinte radiologique d’autres épiphyses, en particulier aux genoux, poignets, et épaules.
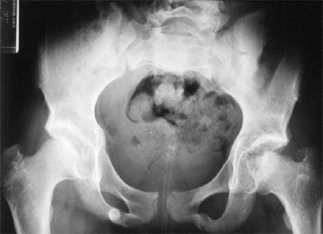 |
|
|
Le traitement de l'ostéochondrite de hanche
L'objectif du traitement
Le but du traitement est de diriger la reconstruction de la tête fémorale afin d’éviter ou de limiter sa déformation, source d’arthrose.
Les principes du traitement
Le traitement repose sur trois grands principes [13,29,37]:
![]() Traiter la
réaction synoviale inflammatoire de la hanche, afin d’améliorer
et de préserver sa mobilité ;
Traiter la
réaction synoviale inflammatoire de la hanche, afin d’améliorer
et de préserver sa mobilité ;
![]() Décider
si l’atteinte de la tête fémorale est suffisamment
sévère pour justifier un traitement supplémentaire
;
Décider
si l’atteinte de la tête fémorale est suffisamment
sévère pour justifier un traitement supplémentaire
;
![]() Dans le cas
où un traitement supplémentaire est indiqué, choisir
le type de traitement qui permet à la tête fémorale
d’être le mieux emboîtée dans l’acétabulum,
pendant l’évolution de la maladie, de façon à
ce que l’articulation de la hanche soit la plus congruente possible
après la phase de reconstruction.
Dans le cas
où un traitement supplémentaire est indiqué, choisir
le type de traitement qui permet à la tête fémorale
d’être le mieux emboîtée dans l’acétabulum,
pendant l’évolution de la maladie, de façon à
ce que l’articulation de la hanche soit la plus congruente possible
après la phase de reconstruction.
 |
|
|
Les moyens de traitement
En allant du plus simple au plus complexe, on peut citer :
La surveillance simple.
La kinésithérapie.
Le repos au lit sans traction.
Le repos au lit avec traction, intermittente ou permanente.
Le fauteuil roulant.
Les béquilles.
Les attelles de décharge (Atlanta, Chicago, Thomas) .
La chirurgie (du fémur, du bassin, ou des deux).
Bien entendu, ces traitement peuvent être associés entre eux, en même temps ou de façon séquentielle.
La stratégie de traitement
La maladie doit être expliquée à l'enfant pour lui faire comprendre les limitations d'activités destinées à soulager les contraintes mécaniques.
La maladie doit également être expliquée à l'entourgae familial et scolaire.
Il est possible pour faciliter la compréhension de l'ostéochondrite de s'aider d'une petite bande dessinée spécialement conçue à cet effet et qui s'appelle "Raoul, sa boule et son moule".
Parfois, une prise en charge psychologique est utile.
 |
|
|
Le traitement peut être chirurgical ou non chirurgical.
Lors de la phase douloureuse de découverte, la résorption de la synovite est en général obtenue après 7 à 10 jours de repos au lit, avec une amélioration consécutive de l’abduction et de la rotation interne [42].
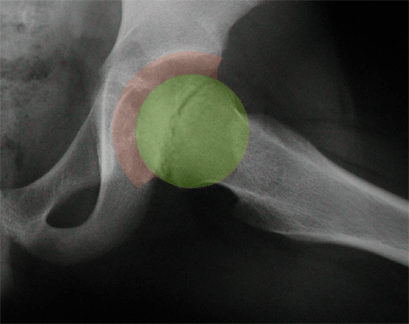
La décision concernant l’institution d’un traitement supplémentaire débute par l’évaluation de l’étendue de l’atteinte de l’épiphyse fémorale, et surtout par l’appréciation de son excentration, c’est à dire le pourcentage de tête fémorale non couvert par l’acétabulum.
Dans les formes minimes et modérées (atteinte de la tête fémorale inférieure à 50%, souvent peu ou pas excentrées), le traitement se limite à maintenir une bonne mobilité de la hanche, jusqu’à la fin de la phase de reconstruction, ce qui fait principalement appel : au repos sportif, à la rééducation (kinésithérapie au rythme de 1 à 2 séances par semaine), à la traction pendant les périodes douloureuses (ou à la traction la nuit pendant plusieurs mois).
 |
|
|
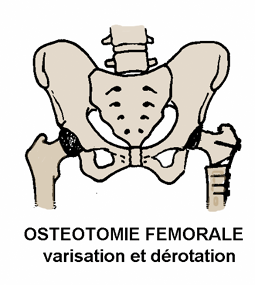
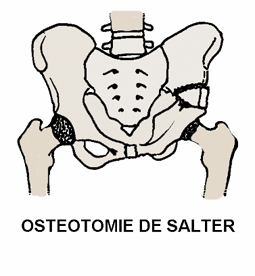
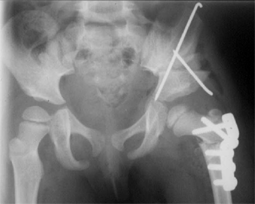
Dans les formes sévères (atteinte de la tête fémorale supérieure à 50%, excentration, incongruence), le traitement consiste à utiliser un appareillage d’abduction (avant l’âge de 5-6 ans), ou à effectuer des gestes chirurgicaux (ostéotomie fémorale ou pelvienne) [19,20,40], dont l’objectif est de permettre à la tête fémorale de bien pénétrer dans l’acétabulum, et d’y rester bien « contenue », pendant toute la phase de reconstruction.
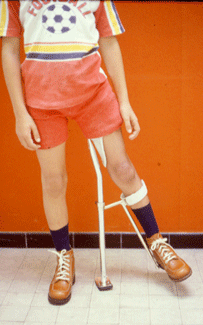 |
 |
 |
|
|
 |
 |
Conclusion
L’ostéochondrite primitive de hanche ou maladie de Legg-Calvé-Perthes, reste une maladie mystérieuse, et chaque patient doit être étudié et traité à part.
Cependant, les travaux de ces dix dernières années ont permis de confirmer et de mettre le point sur certaines notions essentielles :
Le pronostic de cette affection est en général satisfaisant.
Les enfants ayant moins que 50% d’atteinte épiphysaire, auront une grande chance d’avoir une hanche normale en fin de croissance.
Les enfants jeunes (moins que 6 ans pour les garçons, et moins que 5 ans pour les filles) ont plus de chance d’avoir un bon résultat que les enfants plus âgés, ayant une atteinte épiphysaire fémorale identique.
Les enfants ayant le pire résultat à long terme, sont ceux âgés de 10 ans ou plus au moment du diagnostic, et ceux ayant un aplatissement sévère de l’épiphyse fémorale surtout dans sa partie latérale, avant le début du traitement.
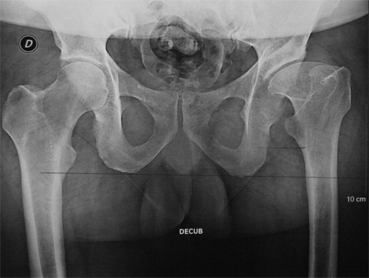
La raideur clinique de la hanche, l’excentration et l’incongruence radiologiques sont des facteurs principaux de mauvais pronostic [26,36,43].
 |
BIBLIOGRAPHIE
1. Arruda V., Belangero W., Ozelo M.,
Oliveira G., Pagnano R., Volpon J., Annichino-Bizzacchi J. : Inherited
risk factors for thrombophilia among children with Legg-Calve-Perthes
disease. J. Pediatr. Orthop. 1999; 19: 84-7.
2. Brenig B., Leeb T., Jansen S., Kopp T. : Analysis of blood clotting
factor activities in canine Legg-Calve-Perthes' disease. J. Vet. Intern.
Med. 1999; 13: 570-3.
3. Cahuzac JP., Sales De Gauzy J., Vidal H., Gaubert J. : The acetabular
opening angle in Perthes’ disease. Radiographic study of 62 unilateral
cases. Acta Orthop. Scand. 1992 ; 63 : 278-81.
4. Catterall A. : The natural history of Perthes’ disease. J.
Bone Joint Surg. Br. 1971 ; 53 : 37-53.
5. Catterall A., Pringle J., Byers PD., et coll. : A review of the morphology
of Perthes’ disease. J. Bone Joint Surg. Br. 1982 ; 64 : 269-75.
6. Diméglio A., Hérisson C., Simon L. : La maladie de
Legg-Perthes-Calvé. Masson, Paris 1999.
7. Ducou-Le Pointe H., Haddad S., Silberman B., Filipe G., Monroe M.,
Montagne JP. : Legg-Perthes-Calvé disease : staging by MRI using
gadolinium. Pediatr. Radiol. 1994 ; 24 : 88-91.
8. Eckerwall G., Hochbergs P., Simesen K., Willen H., Egund N., Wingstrand
H. : Metaphyseal histology and magnetic resonance imaging in Legg-Calve-Perthes
disease. J. Pediatr. Orthop. 1997; 17: 659-62.
9. Gallistl S., Reitinger T., Linhart W., Muntean W.: The role of inherited
thrombotic disorders in the etiology of Legg-Calve-Perthes disease.
J. Pediatr. Orthop. 1999; 19: 82-3.
10. Guille J., Lipton G., Szoke G., Bowen J., Harcke H., Glutting J.
: Legg-Calve-Perthes disease in girls. A comparison of the results with
those seen in boys. J. Bone Joint Surg. Am. 1998; 80: 1256-63.
11. Hayek S., Keret G., Lubetsky A., Rosenberg N., Gitel S., Wientroub
S. : Does thrombophilia play an aetiological role in Legg-Calve-Perthes
disease? J. Bone Joint Surg. Br. 1999; 81: 686-90.
12. Herring JA. : Legg-Calvé-Perthes disease. Pfeffer G. ed.,
Monograph series of the AAOS, Illinois 1996.
13. Herring JA. : The treatment of Legg-Perthes-Calvé disease.
A critical review of the literature. J. Bone Joint Surg. Am. 1994 ;
76 : 448-58.
14. Herring JA., Neustadt J., Williams J., Early J., Browne R. : The
lateral pillar classification of Legg-Perthes-Calvé disease.
J. Pediatr. Orthop. 1992 ; 12 : 143-50.
15. Hochbergs P., Eckerwall G., Egund N., Jonsson K., Wingstrand H .:
Synovitis in Legg-Calve-Perthes disease. Evaluation with MR imaging
in 84 hips. Acta Radiol. 1998; 39: 532-7.
16. Hosokawa M., Kim W., Kubo T., Tsuchida Y., Kusakabe T., Hirasawa
Y. : Preliminary report on usefulness of magnetic resonance imaging
for outcome prediction in early-stage Legg-Calve-Perthes disease. J.
Pediatr. Orthop. B 1999; 8:161-4.
17. Hvid I., Ingerslev J. : Is intravascular coagulation the cause of
Legg-Calve-Perthes disease? Ugeskr Laeger. 1999; 161: 281-9.
18. Jaramillo D., Galen T., Winalski C., DiCanzio J., Zurakowski D.,
Mulkern R., McDougall P., Villegas-Medina O., Jolesz F., Kasser J. :
Legg-Calve-Perthes disease: MR imaging evaluation during manual positioning
of the hip--comparison with conventional arthrography. Radiology. 1999;
212: 519-25.
19. Kitakoji T., Hattori T., Iwata H. : Femoral varus osteotomy in Legg-Calve-Perthes
disease: points at operation to prevent residual problems. J. Pediatr.
Orthop. 1999; 19: 76-81.
20. Kocaoglu M., Kilicoglu O., Goksan S., Cakmak M. : Ilizarov fixator
for treatment of Legg-Calve-Perthes disease. J. Pediatr. Orthop. B 1999;
8: 276-81.
21. Kohler R., Michel CR., Chauvot P., Lahneche B., Pios R. : La scintigraphie
osseuse dans la maladie de Legg-Perthes-Calvé. Rev. Chir. Orthop.
1984 ; 70 : 114-9.
22. Kohler R., Seringe R. : Ostéochondrite primitive de la hanche.
Cahiers d’enseignement de la SOFCOT. Expansion Scientifique Française,
Paris 1981.
23. Lahdes-Vasama T., Lamminen A., Merikanto J., Marttinen E. : The
value of MRI in early Perthes’ disease : An MRI study with a 2-year
follow-up. Pediatr. Radiol. 1997 ; 27 : 517-22.
24. Lahdes-Vasama T., Sipilä I., Lamminranta S., Pihko S., Merikanto
E., Marttinen E. : Psychosocial development and premorbid skeletal growth
in Legg-Calvé-Perthes disease : a study of ninteen patients.
J. Pediatr. Orthp. B 1997 ; 6 : 133-7.
25. Loder R., Farley F., Herring JA., Schork M., Shyr Y. : Bone age
determination in children with Legg-Calvé-Perthes disease : a
comparison of two methods. J. Pediatr. Orthop. 1995 ; 15 : 90-4.
26. Mose K., Hjorth Ulfedt M., Christensen E., Jensen A. : Legg-Calvé-Perthes
disease : the late occurrence of coxarthrosis. Acta Orthop. Scand. 1977
; 169 : 1-39.
27. Neyt J., Weinstein S., Spratt K., Dolan L., Morcuende J., Dietz
F., Guyton G., Hart R., Kraut M., Lervick G., Pardubsky P., Saterbak
A. : Stulberg classification system for evaluation of Legg-Calve-Perthes
disease: intra-rater and inter-rater reliability. J. Bone Joint Surg.
Am. 1999; 81: 1209-16.
28. Roy D. : Current concepts in Legg-Calve-Perthes disease. Pediatr.
Ann. 1999; 28: 748-52.
29. Sales De Gauzy J., Darodes P., Cahuzac J. : Ostéochondrite
primitive de hanche. Encycl. Méd. Chir. (Elsevier, Paris), Appareil
locomoteur, 14-320-A-10, 1999, 13p.
30. Sales De Gauzy J., Kerdiles N., Baunin C., Kany J., Darodes P.,
Cahuzac JP. : Imaging evaluation of subluxation in Legg-Calvé-Perthes
disease : magnetic resonance imaging compared with the plain radiograph.
J. Pediatr. Orthop. B 1997 ; 6 : 235-8.
31. Salter R. Thompson G. : Legg-Calvé-Perthes disease. The prognostic
significance of the subchondral fracture and a two group classification
of the femoral head involvment. J. Bone Joint Surg. Am. 1984 ; 66 :
479-89.
32. Shigeno Y., Evans G. : Quantitative correlation between the initial
and final femoral head deformity in Perthes’ disease. J. Pediatr.
Orthp. B 1996 ; 5 : 48-54.
33. Skaggs D., Tolo V. : Legg-Calve-Perthes Disease. J. Am. Acad. Orthop.
Surg. 1996; 4: 9-16.
34. Song H., Lee S., Na J., Cho S., Jeong S., Ahn B., Koo K. : Comparison
of MRI with subchondral fracture in the evaluation of extent of epiphyseal
necrosis in the early stage of Legg-Calve-Perthes disease. J. Pediatr.
Orthop. 1999; 19: 70-5.
35. Song H., Lee S., Na J., Tymowsi G., Cho S., Koo K. : Relationship
between lateral subluxation and widening of medial joint space in Legg-Calve-Perthes
disease. J. Pediatr. Orthop. 1998; 18: 637-42.
36. Stulberg S., Cooperman D., Wallenstein R. : The natural history
of Legg-Calvé-Perthes disease. J. Bone Joint Surg. Am. 1981 ;
63 : 1095-108.
37. Tolo V., Wood B. : Pediatric Orthopaedics in Primary Care. Williams
and Wilkins, Baltimore 1993.
38. Townsend D. : Legg-Calve-Perthes disease. Orthopedics 1999; 22:
381.
39. Van den Bogaert G., de Rosa E., Moens P., Fabry G., Dimeglio A.
: Bilateral Legg-Calve-Perthes disease: different from unilateral disease?
J. Pediatr. Orthop. B. 1999; 8: 165-8.
40. Vukasinovic Z., Slavkovic S., Milickovic S., Siqeca A. : Combined
salter innominate osteotomy with femoral shortening versus other methods
of treatment for Legg-Calve-Perthes disease. J. Pediatr. Orthop. B.
2000; 9: 28-33.
41. Wall E. : Legg-Calve-Perthes' disease. Curr. Opin. Pediatr. 1999;
11: 76-9.
42. Wingstrand H. : Significance of synovitis in Legg-Calve-Perthes
disease. J. Pediatr. Orthop. B. 1999; 8: 156-60.
43. Yrjonen T. : Long-term prognosis of Legg-Calve-Perthes disease:
a meta-analysis. J. Pediatr. Orthop. B. 1999; 8: 169-72.